Szilícium-dioxid
Ebben a cikkben a Szilícium-dioxid lenyűgöző világát fogjuk felfedezni, elemezve annak hatását és relevanciáját különböző összefüggésekben. Az eredetétől a fejlődéséig elmélyülünk a Szilícium-dioxid legfontosabb vonatkozásaiban, és egy olyan holisztikus látásmódot kínálunk, amely lehetővé teszi az olvasó számára, hogy megértse annak fontosságát ma. Kutatások és kritikai elemzések révén felfedezzük azt a több szempontot, amelyek a Szilícium-dioxid-et a különböző tanulmányi területek érdeklődésére számot tartó témává teszik. Hasonlóképpen megvizsgáljuk a kapcsolatát más releváns témákkal és eseményekkel, átfogó perspektívát adva, amely gazdagítja a Szilícium-dioxid-ről szóló ismereteket.
| Szilícium-dioxid | |||
 Homokdűnék | |||
| |||
| Más nevek | kova, kovasav (helytelen) | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 7631-86-9 | ||
| PubChem | 24261 | ||
| ChemSpider | 22683 | ||
| EINECS-szám | 231-545-4 | ||
| DrugBank | DB11132 | ||
| KEGG | C19572 | ||
| ChEBI | 30563 | ||
| RTECS szám | VV7565000 | ||
| InChIKey | VYPSYNLAJGMNEJ-UHFFFAOYSA-N | ||
| Beilstein | 3902804 | ||
| Gmelin | 200274 | ||
| UNII | ETJ7Z6XBU4 | ||
| ChEMBL | CHEMBL3188292 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | SiO2 | ||
| Moláris tömeg | 60,1 g/mol | ||
| Megjelenés | fehér, kristályos por (tiszta formában) | ||
| Sűrűség | 2,2 g/cm³ | ||
| Olvadáspont | 1650 (±75) °C | ||
| Forráspont | 2230 °C | ||
| Oldhatóság (vízben) | 0,012 g 100g vízben | ||
| Veszélyek | |||
| EU osztályozás | nincsenek veszélyességi szimbólumok[1] | ||
| NFPA 704 | |||
| R mondatok | (nincs)[1] | ||
| S mondatok | (nincs)[1] | ||
| Lobbanáspont | nem gyúlékony | ||
| Rokon vegyületek | |||
| Azonos kation | szilícium-szulfid | ||
| Azonos anion | szén-dioxid germánium-dioxid ón(IV)-oxid ólom(IV)-oxid | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A szilícium-dioxid (köznyelven kova, gyakorta meglehetősen pongyola elnevezéssel kovasav) a szilícium oxigénnel alkotott vegyülete, melynek képlete SiO2. Leggyakoribb ásványa és egyúttal a földkéreg leggyakoribb ásványa a kvarc, egyéb ásványai: opál, kalcedon, jáspis stb. Tengeri üledékekben amorf kova is előfordul; ilyenek például a bizonyos fajta mészkövekben megjelenő tűzkőgumók. Valamennyi meglehetősen kemény anyag; a kvarc keménységét már a 9. században is említik.[2] A természetben leggyakrabban a közönséges homokban található meg. Elsősorban az üveggyártásban, valamint a beton készítésénél alkalmazzák.
Kémiai tulajdonságok
Szobahőmérsékleten viszonylag hosszú idő alatt a szilícium felületén egy rendkívül vékony, körülbelül 1 nanométer vastagságú (10 Å) oxidréteg képződik. A folyamatot fel lehet gyorsítani hevítéssel, és tiszta oxigénnel. Ez a folyamat rendkívül jól szabályozható, ami a mikroelektronikai eszközök készítésénél alapvető elvárás.
Felhasználási területei
A szilícium-dioxid az egyik legszélesebb körben felhasznált vegyület. Főbb alkalmazási területei:
- olcsó, tömeggyártásban készült poharak, ablaküvegek, üvegpalackok stb. készítése
- kerámiák alapanyaga
- cementgyártás alapanyaga
- az élelmiszeriparban csomósodást gátló anyagként, fehérjék sörből, valamint borból történő eltávolítására, és habzásfékezőként alkalmazzák. Előfordulhat továbbá szárított élelmiszerekben, ahol víz megkötésére használják. Napi maximum beviteli mennyisége nincs meghatározva. Szájon át a szervezetbe kerülve nincs ismert mellékhatása.
- a mikroelektronikában a legfontosabb vegyületek közé tartozik, mert rendkívül vékony rétegben is kiváló szigetelőképességgel rendelkezik. Ennek segítségével lehet a mikrométeres mérettartományban működő vezetékeket, integrált áramköröket és kondenzátorokat készíteni.
- az aerogél egyik formájának alapanyaga
- a DNS- és az RNS-kinyerés során is alkalmazzák, mert megköti a nukleinsavakat.
- egyes gyógyszerek esetén habzásgátlóként alkalmazzák
- egyes fogkrémekben is megtalálható.
- abroncsgyártás során a prémium kategóriájú abroncsok egyik alkotó eleme, csökkenti az abroncs gördülési ellenállását
Egészségügyi hatások
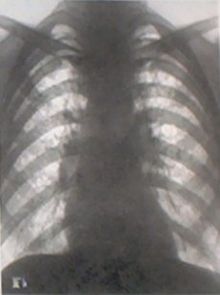

A finom szilícium-dioxid porának belélegzése hosszú távon (még alacsony, 0,1 mg/m³ koncentráció esetén is) szilikózist, bronchitist, valamint egyes esetekben rákot okozhat. A belélegzett molekulák a tüdőbe kerülve megtapadnak annak belső felületén, és folyamatosan ingerlik a nyálkahártyát. Ez az irritáció az idő múlásával sem csökken, ugyanis a szilícium-dioxid nem távozik onnan. Gyerekek vagy asztmások esetében a tünetek sokkal hamarabb jelentkezhetnek.
A szilícium-dioxid más módon a szervezetbe kerülve teljesen ártalmatlan vegyület. Nem lép reakcióba semmivel sem, a szájon át bekerült mennyiség általában minden mellékhatás nélkül, a széklettel távozik. Nagy mennyiségben megkötheti a vizet, ezáltal enyhe székrekedést okoz. Semmiféle mérgező hatása, és semmi tápértéke sincs.
Jegyzetek
- ↑ a b c A szilícium-dioxid vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. A hozzáférés dátuma: 2010. december 29. (JavaScript szükséges) (angolul)
- ↑ Lynn Townsend White, Jr. (Spring, 1961). "Eilmer of Malmesbury, an Eleventh Century Aviator: A Case Study of Technological Innovation, Its Context and Tradition", Technology and Culture 2 (2), pp. 97-111 .


