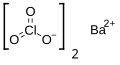Bárium-klorát
A mai világban a Bárium-klorát egyre fontosabbá vált. Akár az egészségügy, a technológia, az oktatás vagy bármely más területről van szó, a Bárium-klorát felkeltette a szakértők és a nagyközönség figyelmét. Az évek során tanúi lehettünk annak, hogy a Bárium-klorát hogyan fejlődött, és hogyan vált kulcsfontosságú kérdéssé társadalmunkban. Ebben a cikkben alaposan megvizsgáljuk a Bárium-klorát minden oldalát, a történetétől a jelenlegi alkalmazásaiig, azzal a céllal, hogy teljes és részletes áttekintést nyújtsunk a mai világban betöltött fontosságáról.
| Bárium-klorát | |||

| |||
| |||
| IUPAC-név | Bárium-klorát | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 13477-00-4 | ||
| PubChem | 26059 | ||
| ChemSpider | 24273 | ||
| EINECS-szám | 236-760-7 | ||
| RTECS szám | FN9770000 | ||
| InChIKey | ISFLYIRWQDJPDR-UHFFFAOYSA-L | ||
| UNII | GRW9DUG818 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | Ba(ClO3)2 | ||
| Moláris tömeg | 304,23 g/mol | ||
| Megjelenés | fehér színű, szilárd | ||
| Sűrűség | 3,18 g/cm³ (monohidrát)[1] | ||
| Olvadáspont | 413.9 °C megolvad 250 °C-on olvadáspontja alatt bomlik[1] | ||
| Oldhatóság (vízben) | 275 g/l, 20 °C[1] | ||
| Veszélyek | |||
| EU osztályozás | Oxidáló (O) Ártalmas (Xn) Veszélyes a környezetre (N)[1] | ||
| R mondatok | R9, R20/22, R51/53[1] | ||
| S mondatok | (S2), S13, S27, S61[1] | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A bárium-klorát egy szervetlen vegyület, a klórsav báriumsója. Színtelen kristályokat vagy fehér színű port alkot, és mint minden oldható báriumvegyület, irritáló és mérgező. Jól oldódik vízben, 20 °C-on 100 gramm vízben 33,8 g, 90 °C-on 95 g oldódik fel. Egy molekula kristályvízzel kristályosodik (Ba(ClO3)2 · H2O). 120 °C-on a kristályvizet elveszíti. Zöld lángfestése miatt a bárium-klorátot a pirotechnikában használják fel a láng zöldre festéséhez.
Kémiai tulajdonságai
Hevítéskor a bárium-klorát először a kristályvizét veszíti el, majd elbomlik. A bomlás során oxigén fejlődik és bárium-klorid keletkezik.
Ha jóddal reagáltatják, klórfejlődés közben bárium-jodáttá alakul.
Erős oxidálószer.
Előállítása
Ha bárium-klorid oldatot elekrtolizálnak, az anódtérben bárium-klorát képződik. Előállítható bárium-hidroxidból is, ha vizes oldatát ammónium-kloráttal hevítik, majd lehűtik és bepárolják.
- .
Felhasználása
A bárium-klorátot más klorátok és klórsav előállítására használják. Tűzijátékokban is alkalmazzák a láng zöldre festéséhez. A bárium-kloráttal készült villanópor nagyon fényes, kissé zöldes színű és jóval erősebb mint a bárium-nitrát alapú.
Oldatának elektrolízisével készül a bárium-perklorát.
Jegyzetek
Források
Erdey-Grúz Tibor: Vegyszerismeret